Paano gumagana at gumagana ang mga baterya
 Sa pinakamalawak na kahulugan ng salita sa teknolohiya, ang terminong "baterya" ay tumutukoy sa isang aparato na nagbibigay-daan sa ilalim ng ilang partikular na kondisyon ng pagpapatakbo na makaipon ng isang tiyak na uri ng enerhiya, at sa iba pa na gamitin ito para sa mga pangangailangan ng tao.
Sa pinakamalawak na kahulugan ng salita sa teknolohiya, ang terminong "baterya" ay tumutukoy sa isang aparato na nagbibigay-daan sa ilalim ng ilang partikular na kondisyon ng pagpapatakbo na makaipon ng isang tiyak na uri ng enerhiya, at sa iba pa na gamitin ito para sa mga pangangailangan ng tao.
Ginagamit ang mga ito kung saan kinakailangan upang mangolekta ng enerhiya para sa isang tiyak na oras at pagkatapos ay gamitin ito upang magsagawa ng malalaking proseso ng paggawa. Halimbawa, ang mga hydraulic accumulator na ginagamit sa mga kandado ay nagpapahintulot sa mga barko na tumaas sa isang bagong antas sa ilalim ng ilog.
Gumagana ang mga de-koryenteng baterya sa koryente sa parehong prinsipyo: una, nag-iipon (nag-iipon) ng kuryente mula sa isang panlabas na pinagmumulan ng pag-charge at pagkatapos ay ibinibigay ito sa mga konektadong consumer para magtrabaho. Sa pamamagitan ng kanilang likas na katangian, nabibilang sila sa kasalukuyang mga mapagkukunan ng kemikal na may kakayahang magsagawa ng mga panaka-nakang siklo ng paglabas at pagsingil nang paulit-ulit.
Sa panahon ng operasyon, ang mga reaksiyong kemikal ay patuloy na nagaganap sa pagitan ng mga bahagi ng mga plato ng elektrod kasama ang kanilang pagpuno na sangkap - electrolyte.
Ang isang diagram ng eskematiko ng isang aparato ng baterya ay maaaring kinakatawan ng isang pinasimple na pagguhit kapag ang dalawang plato ng magkakaibang mga metal na may mga wire ay ipinasok sa katawan ng sisidlan upang magbigay ng mga de-koryenteng kontak. Ang isang electrolyte ay ibinuhos sa pagitan ng mga plato.
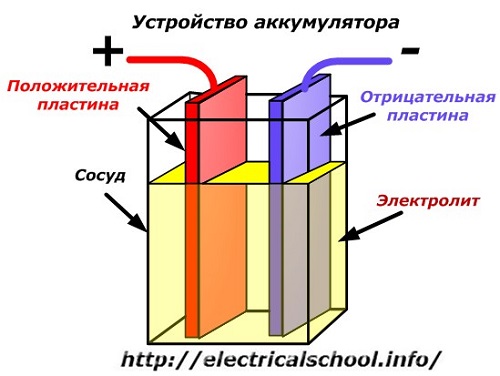
Pagpapatakbo ng baterya kapag na-discharge
Kapag ang isang load, tulad ng isang ilaw na bombilya, ay konektado sa mga electrodes, isang closed electrical circuit ay nilikha kung saan ang discharge current ay dumadaloy. Ito ay nabuo sa pamamagitan ng paggalaw ng mga electron sa mga bahagi ng metal at mga anion na may mga cation sa electrolyte.
Ang prosesong ito ay karaniwang ipinapakita sa isang diagram na may disenyong nickel-cadmium electrode.
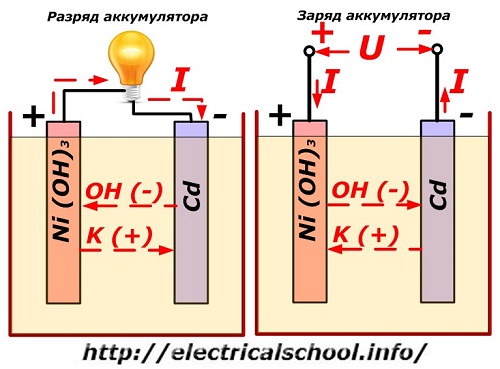
Dito, ang mga nickel oxide na may mga graphite additives, na nagpapataas ng electrical conductivity, ay ginagamit bilang materyal ng positibong elektrod. Ang metal ng negatibong elektrod ay spongy cadmium.
Sa panahon ng paglabas, ang mga aktibong particle ng oxygen mula sa mga nickel oxide ay inilalabas sa electrolyte at idinidirekta sa mga negatibong plato, kung saan ang cadmium ay na-oxidized.
Pagganap ng baterya kapag nagcha-charge
Kapag ang pag-load ay naka-off, ang isang pare-pareho (sa ilang mga sitwasyon, pulsating) boltahe ay inilalapat sa mga terminal ng plato ng isang mas mataas na halaga kaysa sa isang naka-charge na baterya ng parehong polarity, kapag ang plus at minus na mga terminal ng pinagmulan at consumer ay nag-tutugma .
Ang charger ay palaging may higit na kapangyarihan, na "pinipigilan" ang natitirang enerhiya sa baterya at lumilikha ng isang electric current sa kabaligtaran na direksyon ng discharge. Bilang isang resulta, ang mga panloob na proseso ng kemikal sa pagitan ng mga electrodes at ang electrolyte ay nagbabago. Halimbawa, sa isang kahon ng mga nickel-cadmium plate, ang positibong elektrod ay pinayaman ng oxygen, at ang negatibo - sa isang estado ng purong cadmium.
Kapag ang baterya ay na-discharge at na-charge, ang kemikal na komposisyon ng materyal ng mga plato (electrodes) ay nagbabago, ngunit ang electrolyte ay hindi nagbabago.
Mga paraan ng koneksyon sa baterya
Parallel na koneksyon
Ang dami ng kasalukuyang discharge na maaaring mapaglabanan ng isang tao ay depende sa maraming mga kadahilanan, ngunit pangunahin ang disenyo, mga materyales na ginamit at ang kanilang mga sukat. Kung mas malaki ang lugar ng mga plato sa mga electrodes, mas malaki ang kasalukuyang maaari nilang mapaglabanan.
Ang prinsipyong ito ay ginagamit upang ikonekta ang mga cell ng parehong uri nang magkatulad sa mga baterya kapag kinakailangan upang taasan ang kasalukuyang sa pagkarga. Ngunit upang singilin ang gayong disenyo, kakailanganing dagdagan ang kapangyarihan ng pinagmulan. Ang pamamaraang ito ay bihirang ginagamit para sa mga yari na istruktura, dahil ngayon ay mas madaling bumili ng kinakailangang baterya. Ngunit ginagamit ito ng mga tagagawa ng baterya ng acid, na kumukonekta sa iba't ibang mga plato sa mga solong bloke.
Serial na koneksyon
Depende sa mga materyales na ginamit, ang boltahe na 1.2 / 1.5 o 2.0 volts ay maaaring mabuo sa pagitan ng dalawang electrode plate ng mga baterya na karaniwan sa pang-araw-araw na buhay. (Sa totoo lang, mas malawak ang saklaw na ito.) Malinaw, hindi ito sapat para sa maraming mga de-koryenteng aparato. Samakatuwid, ang mga baterya ng parehong uri ay konektado sa serye, at ito ay madalas na ginagawa sa isang kaso.
Ang isang halimbawa ng naturang disenyo ay ang malawakang pag-unlad ng automotive batay sa sulfuric acid at lead electrode plates.
Karaniwan, sa mga tao, lalo na sa mga driver ng transportasyon, kaugalian na tawagan ang anumang aparato ng baterya, anuman ang bilang ng mga elemento ng nasasakupan nito - mga kahon. Gayunpaman, hindi ito ganap na tama.Ang istraktura, na binuo mula sa ilang mga kahon na konektado sa serye, ay isang baterya na, kung saan ang pinaikling pangalan na «АКБ» ay nakakabit... Ang panloob na istraktura nito ay ipinapakita sa figure.
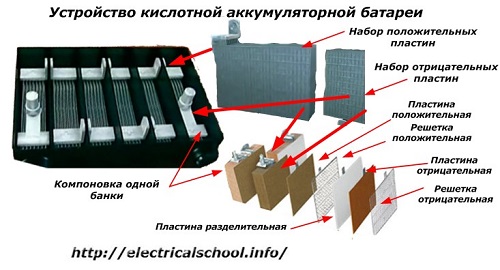
Ang bawat isa sa mga garapon ay binubuo ng dalawang bloke na may isang hanay ng mga plato para sa positibo at negatibong mga electrodes. Ang mga bloke ay magkasya sa bawat isa nang walang metal contact na may posibilidad ng isang maaasahang koneksyon ng galvanic sa pamamagitan ng electrolyte.
Sa kasong ito, ang mga contact plate ay may karagdagang grid at pinaghihiwalay sa bawat isa ng isang separator plate.
Ang pagkonekta sa mga plato sa mga bloke ay nagdaragdag sa kanilang lugar ng pagtatrabaho, binabawasan ang kabuuang paglaban ng buong istraktura at nagbibigay-daan sa iyo upang madagdagan ang kapangyarihan ng konektadong pagkarga.
Sa labas ng kahon, ang naturang baterya ay may mga elementong ipinapakita sa figure sa ibaba.
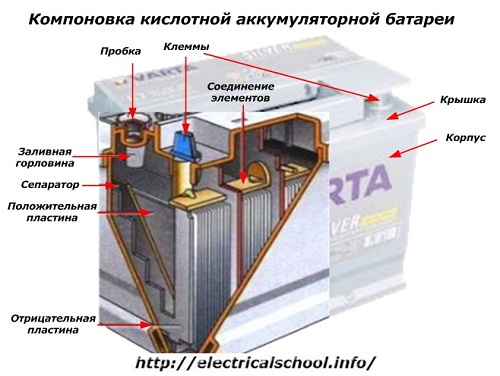
Ipinapakita nito na ang matibay na plastic housing ay natatakan ng takip at nilagyan ng dalawang terminal (karaniwang hugis-kono) sa itaas para sa koneksyon sa electrical circuit ng kotse. Ang mga polarity marking ay nakatatak sa kanilang mga terminal: «+» at «-«. Karaniwan ang positibong terminal ay may bahagyang mas malaking diameter kaysa sa negatibong terminal upang harangan ang mga error sa mga kable.
Ang mga magagamit na baterya ay may butas na tagapuno sa tuktok ng bawat garapon upang makontrol ang antas ng electrolyte o magdagdag ng distilled water sa panahon ng operasyon. Ang isang plug ay screwed sa ito, na pinoprotektahan ang mga panloob na cavities ng kaso mula sa kontaminasyon at sa parehong oras na pinipigilan ang electrolyte mula sa spilling kapag ang baterya ay tumagilid.
Dahil sa isang malakas na singil, ang pag-gas mula sa electrolyte ay posible (at ang prosesong ito ay posible sa panahon ng masinsinang pagmamaneho), ang mga butas ay ginawa sa mga plug upang maiwasan ang pagtaas ng presyon sa loob ng kahon.Ang oxygen at hydrogen, pati na rin ang mga electrolyte vapor, ay lumalabas sa kanila. Inirerekomenda na iwasan ang mga ganitong sitwasyon na kinasasangkutan ng labis na pag-charge ng mga alon.
Ang parehong figure ay nagpapakita ng koneksyon ng mga elemento sa pagitan ng mga bangko at ang pag-aayos ng mga plato ng elektrod.
Gumagana ang mga baterya ng car starter (lead acid) sa prinsipyo ng double sulphation. Sa panahon ng paglabas / pagsingil, isang proseso ng electrochemical ang nagaganap sa kanila, na sinamahan ng isang pagbabago sa komposisyon ng kemikal ng aktibong masa ng mga electrodes na may paglabas / pagsipsip ng tubig sa electrolyte (sulfuric acid).
Ipinapaliwanag nito ang pagtaas sa partikular na gravity ng electrolyte kapag nagcha-charge at ang pagbaba kapag ang baterya ay na-discharge. Sa madaling salita, ang halaga ng density ay nagbibigay-daan sa iyo upang masuri ang kondisyon ng kuryente ng baterya. Ang isang espesyal na aparato ay ginagamit upang sukatin ito - isang hydrometer ng kotse.
Ang distilled water, na bahagi ng electrolyte ng mga acid na baterya, ay nagiging solid state - yelo sa mga negatibong temperatura. Samakatuwid, upang maiwasan ang pagyeyelo ng mga baterya ng kotse sa malamig na panahon, kinakailangang maglapat ng mga espesyal na hakbang na ibinigay para sa mga patakaran para sa pagsasamantala.
Anong mga uri ng mga baterya ang mayroon?
Ang modernong produksyon para sa iba't ibang layunin ay gumagawa ng higit sa tatlong dosenang mga produkto na may iba't ibang komposisyon ng mga electrodes at electrolyte. 12 kilalang modelo ay tumatakbo sa lithium lamang.

Ang mga sumusunod ay matatagpuan bilang electrode metal:
-
tingga;
-
bakal;
-
lithium;
-
titan;
-
kobalt;
-
kadmyum;
-
nikel;
-
sink;
-
pilak;
-
vanadium;
-
aluminyo
-
ilang iba pang mga item.
Nakakaapekto ang mga ito sa mga katangian ng electrical output at samakatuwid ay ang application.
Ang kakayahang makatiis ng panandaliang mataas na pagkarga na nagreresulta mula sa pag-ikot ng mga crankshaft ng panloob na combustion engine ng mga electric starter motor ay katangian ng mga lead-acid na baterya. Malawakang ginagamit ang mga ito sa transportasyon, walang patid na mga supply ng kuryente at emergency power system.
Pamantayan galvanic cells (mga regular na baterya) ay karaniwang pinapalitan ng nickel-cadmium, nickel-zinc at nickel-metal hydride na mga baterya.
Ngunit ang mga disenyo ng lithium-ion o lithium-polymer ay gumagana nang mapagkakatiwalaan sa mga mobile at computing device, mga tool sa pagtatayo, at maging sa mga de-kuryenteng sasakyan.
Ayon sa uri ng electrolyte na ginamit, ang mga baterya ay:
-
maasim
-
alkalina.
Mayroong pag-uuri ng mga baterya ayon sa layunin. Halimbawa, sa mga modernong kondisyon, lumitaw ang mga device na ginagamit para sa paglilipat ng enerhiya — pag-recharge ng iba pang mapagkukunan. Ang tinatawag na panlabas na baterya ay tumutulong sa mga may-ari ng maraming mga mobile device sa kawalan ng isang alternating electrical network. Nagagawa nitong paulit-ulit na singilin ang isang tablet, smartphone, mobile phone.
Ang lahat ng mga baterya ay may parehong prinsipyo ng pagpapatakbo at isang katulad na aparato. Halimbawa, ang modelo ng daliri ng lithium-ion na ipinapakita sa figure sa ibaba sa maraming paraan ay inuulit ang disenyo ng mga acid na baterya na tinalakay kanina.
Dito nakikita natin ang parehong contact electrodes, plates, separator at housing. Tanging ang mga ito ay ginawa na isinasaalang-alang ang iba pang mga kondisyon sa pagtatrabaho.
Mga pangunahing katangian ng elektrikal ng isang baterya
Ang pagpapatakbo ng aparato ay apektado ng mga parameter:
-
kapasidad;
-
density ng enerhiya;
-
paglabas sa sarili;
-
rehimen ng temperatura.
Ang kapasidad ay tinatawag na pinakamataas na singil ng baterya, na nagagawa nitong ibigay sa panahon ng paglabas sa pinakamababang boltahe. Ito ay ipinahayag sa mga pendants (SI system) at ampere-hours (non-system unit).
Bilang isang uri ng kapasidad mayroong «kapasidad ng enerhiya», na tumutukoy sa enerhiya na inilabas sa panahon ng paglabas sa pinakamababang pinapayagang boltahe. Ito ay sinusukat sa joules (SI) at watt-hours (non-SI units).
Ang density ng enerhiya ay ipinahayag bilang ratio ng dami ng enerhiya sa bigat o dami ng baterya.
Isinasaalang-alang ng self-discharge ang pagkawala ng kapasidad pagkatapos mag-charge sa kawalan ng load sa mga terminal. Depende ito sa disenyo at pinalala ng pagkakabukod ng pagkakabukod sa pagitan ng mga electrodes sa maraming dahilan.
Ang temperatura ng pagpapatakbo ay nakakaapekto sa mga de-koryenteng katangian at sa kaso ng mga malubhang paglihis mula sa pamantayan na tinukoy ng tagagawa, maaari itong makapinsala sa baterya. Ang init at lamig ay hindi katanggap-tanggap, nakakaapekto ito sa kurso ng mga reaksiyong kemikal at ang presyon ng kapaligiran sa loob ng kahon.
